Las reacciones químicas se representan de manera abreviada mediante las ecuaciones
Una ecuación química es algo parecido a una igualdad matemática en la que escribimos a la izquierda las sustancias de partida, los reactivos, y a la derecha, los productos obtenidos en la reacción. Entre los reactivos y los productos escribimos una flecha que apunta desde los primeros a los segundos, que indica que a partir de los reactivos se obtienen los productos.
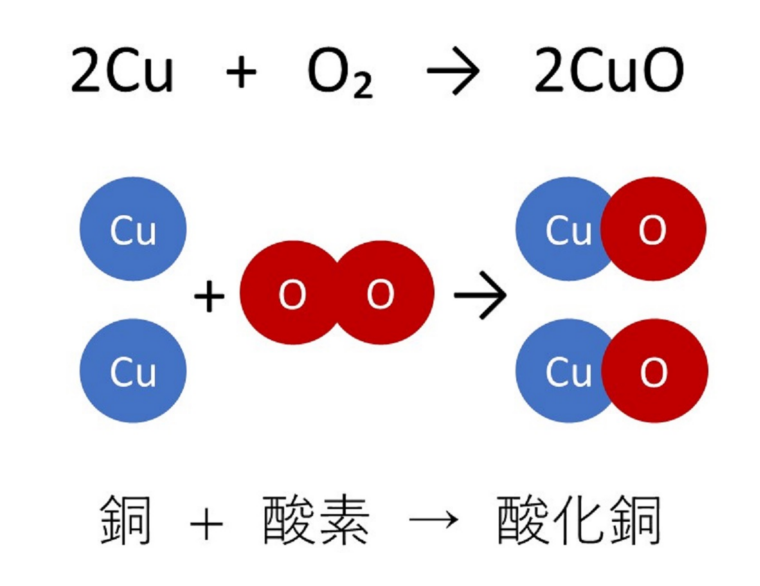
Una reacción química, como ya hemos visto, consiste en una nueva agrupación de los átomos, por tanto los átomos que tenemos al principio de la reacción tienen que ser los mismos que tenemos después, pero unidos entre sí de manera diferente.
Por tanto, en una ecuación química, el número de átomos de cada elemento tiene que ser el mismo a la izquierda y a la derecha de la flecha. Para que esto sea así, tenemos que colocar unos números delante de la fórmula de las sustancias que intervienen, llamados coeficientes estequiométricos. Entonces decimos que la ecuación química está ajustada.
Un coeficiente estequiométrico indica las veces que se repite cada fórmula. Por ejemplo, si colocamos un "2" delante de la fórmula de una molécula de agua "2 H2O" esto indica que estamos considerando 2 moléculas de agua, es decir, 4 átomos de H y 2 átomos de O.
Reacción química
|
El hidrógeno y el oxígeno reaccionan entre sí para formar agua |
Ecuación química sin ajustar
|
H2 + O2 → H2O |
| Número átomos en la ecuación sin ajustar |
2H 2O ≠ 2H 1O |
|
Ecuación química ajustada
|
2 H2 + O2 → 2 H2O |
| Número de átomos en la ecuación ajustada |
4H 2O = 4H 2O |
Representación molecular
|
 |
En el ejemplo anterior, hemos escrito la ecuación química correspondiente a la formación de agua a partir de sus elementos:
- Lo primero que hemos hecho ha sido escribir las fórmulas de los reactivos y los productos, separados por una flecha.
- Después hemos contado los átomos de cada elemento a la derecha y a la izquierda de la flecha. A la izquierda hay 2 H y 2 O, y a la derecha, 2 H y 1 O. Esto indica que la ecuación está sin ajustar.
- Para ajustar la ecuación hemos colocado un 2 delante del H2O para tener también 2 O a la derecha, pero ahora hay 4 H a la derecha. Para que el número de H sea el mismo, hemos colocado un 2 a la izquierda delante del H2.
- Como ves en la representación molecular, ahora tenemos 4 H y 4 O a ambos lados de la flecha.